2026年亞洲保健品出口美國為何成為黃金機會?
是的,2026年是亞洲保健品業者進軍美國市場的關鍵時機。 主要原因包括:(1) 美國消費者對亞洲傳統保健成分(如人參、靈芝、薑黃)需求持續成長,(2) FSMA法規{:target=”_blank”}實施後供應鏈透明度要求提高,具備完整追溯系統的亞洲製造商更具競爭優勢,(3) 跨境電商平台(Amazon、iHerb)降低進入門檻,台灣中小型業者可透過FDA合規認證快速切入利基市場。
根據 FDA對膳食補充劑的定義{:target=”_blank”},保健品(Dietary Supplements)在美國屬於特殊食品類別,需符合特定標籤、成分與製造規範。台灣業者若能提前掌握FDA要求,將在2026年市場競爭中取得先機。
為何台灣保健品業者需要了解美國FDA法規?
台灣保健品產業具備優質製造能力與成本優勢,但出口美國時常因不熟悉FDA法規而面臨扣關、產品下架等風險。美國市場對保健品的管理與台灣「健康食品管理法」有根本差異:台灣採「事前審查制」,美國則採「事後監督制」,業者需自行確保產品符合 CFR Title 21 Part 111(膳食補充劑cGMP規範){:target=”_blank”}。
2026年隨著Amazon等平台加強FDA合規審查,未完成 FDA食品設施註冊{:target=”_blank”} 或缺乏美國代理人的產品將無法上架銷售。此外,FSMA法規要求進口商執行 FSVP(外國供應商驗證計畫){:target=”_blank”},台灣製造商需提供完整的食品安全文件與追溯記錄,才能通過美國進口商審核。
若尚未建立對FDA食品註冊制度的整體理解,建議先從完整總覽入手,有助於後續判斷不同情境與執行差異。
👉 FDA 食品註冊完整指南|台灣食品出口美國必讀(2026 最新)
https://greenoo.tw/fda-food-registration/
2026年亞洲保健品出口美國的三大核心合規要求
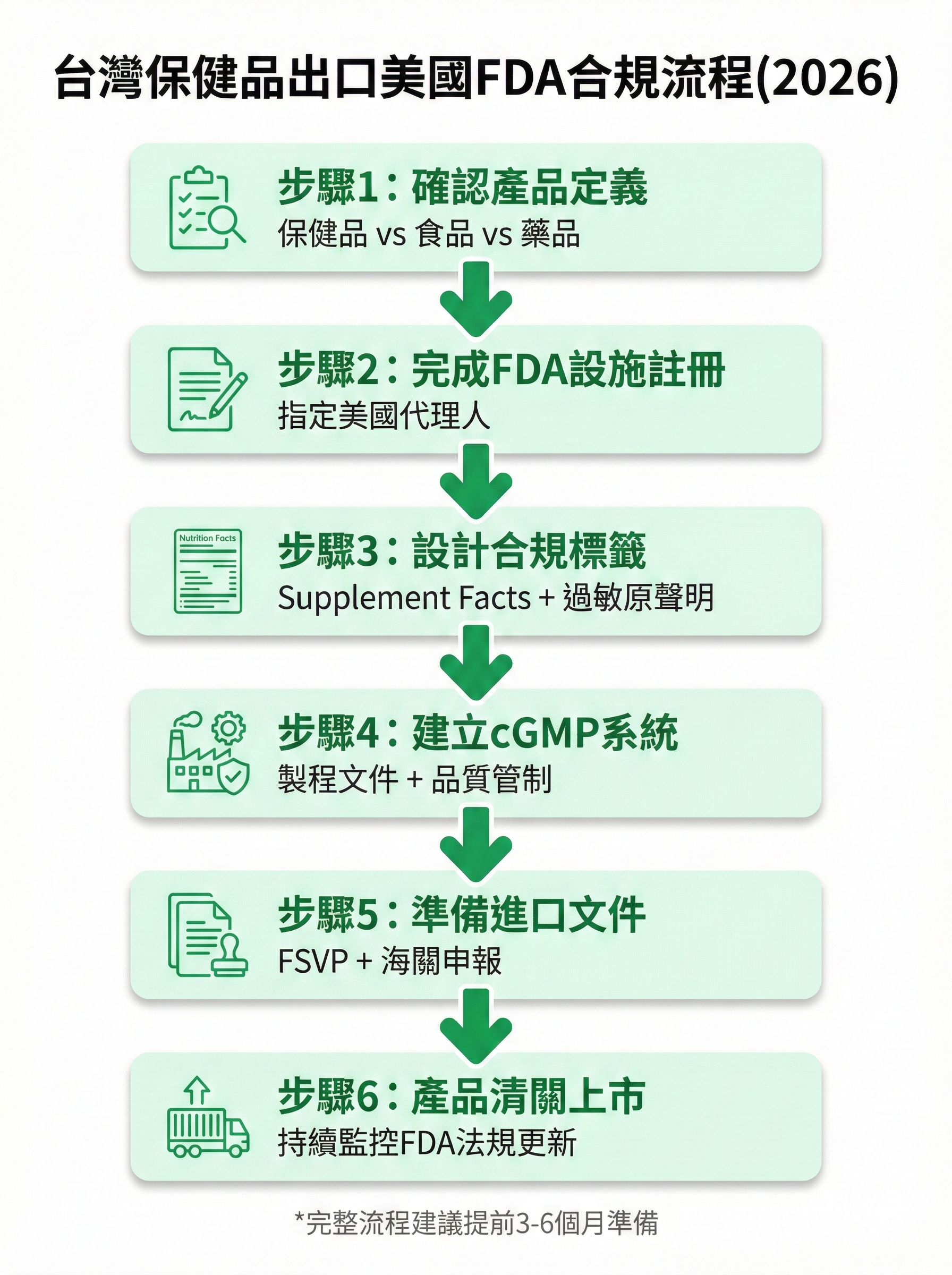
1. FDA食品設施註冊與美國代理人指定
所有製造、加工、包裝或倉儲保健品並出口至美國的台灣工廠,必須完成FDA食品設施註冊(Food Facility Registration, FFR)。註冊時需指定一位位於美國的代理人(US Agent),作為FDA與工廠間的聯絡窗口。
常見誤區:許多台灣業者誤以為「透過Amazon FBA出貨就不需要註冊」,實際上只要產品進入美國境內,製造工廠就必須完成註冊。未註冊的產品可能在海關被扣留,甚至面臨進口警示(Import Alert)限制。
2. 膳食補充劑標籤合規(Supplement Facts)
保健品標籤必須符合 FDA膳食補充劑標籤規範{:target=”_blank”},包含:
- Supplement Facts標示:列出每份含量、每日參考值百分比(%DV)
- 成分列表:依含量由高到低排序,標示所有活性成分與賦形劑
- 過敏原聲明:若含有8大過敏原(牛奶、蛋、魚、甲殼類、堅果、花生、小麥、大豆)需明確標示
- 製造商資訊:包含公司名稱與地址(可為美國代理人地址)
實務技巧:台灣業者常使用的「保健功效宣稱」(如「增強免疫力」「改善睡眠」)在美國需符合特定格式,避免觸及「疾病治療宣稱」(Disease Claims)而被FDA視為未經核准藥品。
3. cGMP製造規範與品質管理
依據 CFR § 111{:target=”_blank”},保健品製造商必須建立並執行現行良好製造規範(cGMP),包含:
- 原料驗收與檢驗程序
- 製程管制與批次記錄
- 成品檢驗與放行標準
- 設備清潔與維護
- 員工訓練與衛生管理
進階說明:雖然FDA不要求事前工廠檢查,但保留隨時稽查權力。2026年FDA持續加強對進口保健品的抽驗,建議台灣業者提前建立完整的cGMP文件系統,降低被稽查時的合規風險。
圖 2: 台灣保健品出口美國FDA合規流程圖
台灣業者常見的FDA合規誤區與風險規避
誤區1: 「保健食品」與「膳食補充劑」混淆
台灣的「健康食品」需經衛福部審查核准,但美國的「膳食補充劑」(Dietary Supplements)不需FDA事前核准,業者可自行上市銷售。然而,這不代表可以隨意宣稱功效,FDA對於「結構/功能宣稱」(Structure/Function Claims)與「疾病治療宣稱」有嚴格區分。
正確做法:使用經FDA認可的免責聲明格式,如「本產品不用於診斷、治療、治癒或預防任何疾病」(This statement has not been evaluated by the FDA. This product is not intended to diagnose, treat, cure, or prevent any disease.)。
誤區2: 忽略新膳食成分通知(NDI Notification)
若產品含有1994年10月15日後才在美國市場銷售的「新膳食成分」(New Dietary Ingredient, NDI),需在上市前75天向FDA提交NDI通知。許多台灣業者使用的亞洲傳統成分(如特定菌株益生菌、新型植物萃取物)可能屬於NDI範圍。
風險規避:產品配方設計階段即應確認成分是否為NDI,必要時提前提交通知或調整配方使用已有安全使用歷史的成分。
誤區3: 低估Amazon平台合規審查力度
2026年Amazon持續強化FDA合規審查,要求賣家提供:
- FDA食品設施註冊編號(FFR Number)
- 美國代理人資訊
- 產品標籤照片(需符合FDA規範)
- cGMP符合性聲明
實務案例:某台灣保健品賣家因未完成FDA註冊,產品在Amazon上架後被平台下架,損失數月銷售業績與廣告投資。
若進一步關心Amazon平台對FDA食品註冊的審核要求,可參考以下說明頁面,以釐清實務上的判斷重點。
👉 Amazon 為何要求 FDA 食品註冊?平台審核規則完整解析(2026)
https://greenoo.tw/fda-food-registration-amazon-fda-food-registration-requirements/
圖 3: 台灣保健品業者FDA合規檢核表

2026年台灣保健品業者的市場策略建議
| 策略面向 | 具體做法 | 預期效益 |
|---|---|---|
| 法規先行 | 提前3-6個月完成FDA註冊與標籤設計 | 避免清關延誤,降低扣關風險 |
| 利基市場 | 聚焦亞洲傳統成分(人參、靈芝、薑黃) | 差異化競爭,建立品牌特色 |
| 平台合規 | 同步準備Amazon、iHerb等平台審查文件 | 快速上架,縮短市場進入時間 |
| 供應鏈透明 | 建立完整原料追溯與檢驗報告系統 | 符合FSVP要求,提升進口商信任 |
| 持續監控 | 訂閱FDA法規更新通知,定期檢視合規狀態 | 即時因應法規變動,維持市場競爭力 |
進階建議:考慮與美國進口商或經銷商建立長期合作關係,由對方協助處理FSVP驗證與市場推廣,台灣業者專注於產品研發與製造品質管控。
若進一步關心FDA食品註冊的申請流程與所需文件,可參考以下說明頁面,以釐清實務上的判斷重點。
👉 FDA 食品註冊流程與文件完整說明|台灣申請重點整理(2026)
https://greenoo.tw/fda-food-registration-fda-food-registration-process-and-documents-taiwan/
總結
2026年亞洲保健品市場持續成長,台灣業者具備優質製造能力與成本優勢,但出口美國需克服FDA法規門檻。關鍵重點包括:
- 完成FDA食品設施註冊,指定美國代理人
- 標籤符合Supplement Facts規範,避免疾病治療宣稱
- 建立cGMP製造系統,準備完整品質文件
- 確認新膳食成分(NDI)要求,必要時提前通知FDA
- 符合Amazon等平台合規審查,加速產品上市
- 建立供應鏈追溯系統,滿足FSVP進口商驗證需求
提前規劃與專業顧問協助,將大幅降低合規風險,掌握2026年美國保健品市場黃金機會。
若對FDA保健品合規仍有疑問,歡迎參考 綠圈圈官網 的專業顧問服務。
參考資料
本文內容基於以下FDA官方資料撰寫(截至2026年1月):
- U.S. Food and Drug Administration. “Dietary Supplements.” FDA.gov, https://www.fda.gov/food/dietary-supplements
- U.S. Food and Drug Administration. “FSMA Final Rule on Foreign Supplier Verification Programs (FSVP) for Importers of Food for Humans and Animals.” FDA.gov, https://www.fda.gov/food/food-safety-modernization-act-fsma/fsma-final-rule-foreign-supplier-verification-programs-fsvp-importers-food-humans-and-animals
- Code of Federal Regulations Title 21, Part 111. “Current Good Manufacturing Practice in Manufacturing, Packaging, Labeling, or Holding Operations for Dietary Supplements.” eCFR, https://www.ecfr.gov/current/title-21/chapter-I/subchapter-B/part-111
- U.S. Food and Drug Administration. “Dietary Supplement Labeling Guide.” FDA.gov, https://www.fda.gov/food/food-labeling-nutrition/dietary-supplement-labeling-guide
註:FDA法規可能更新,建議查閱最新官方文件或諮詢專業顧問。