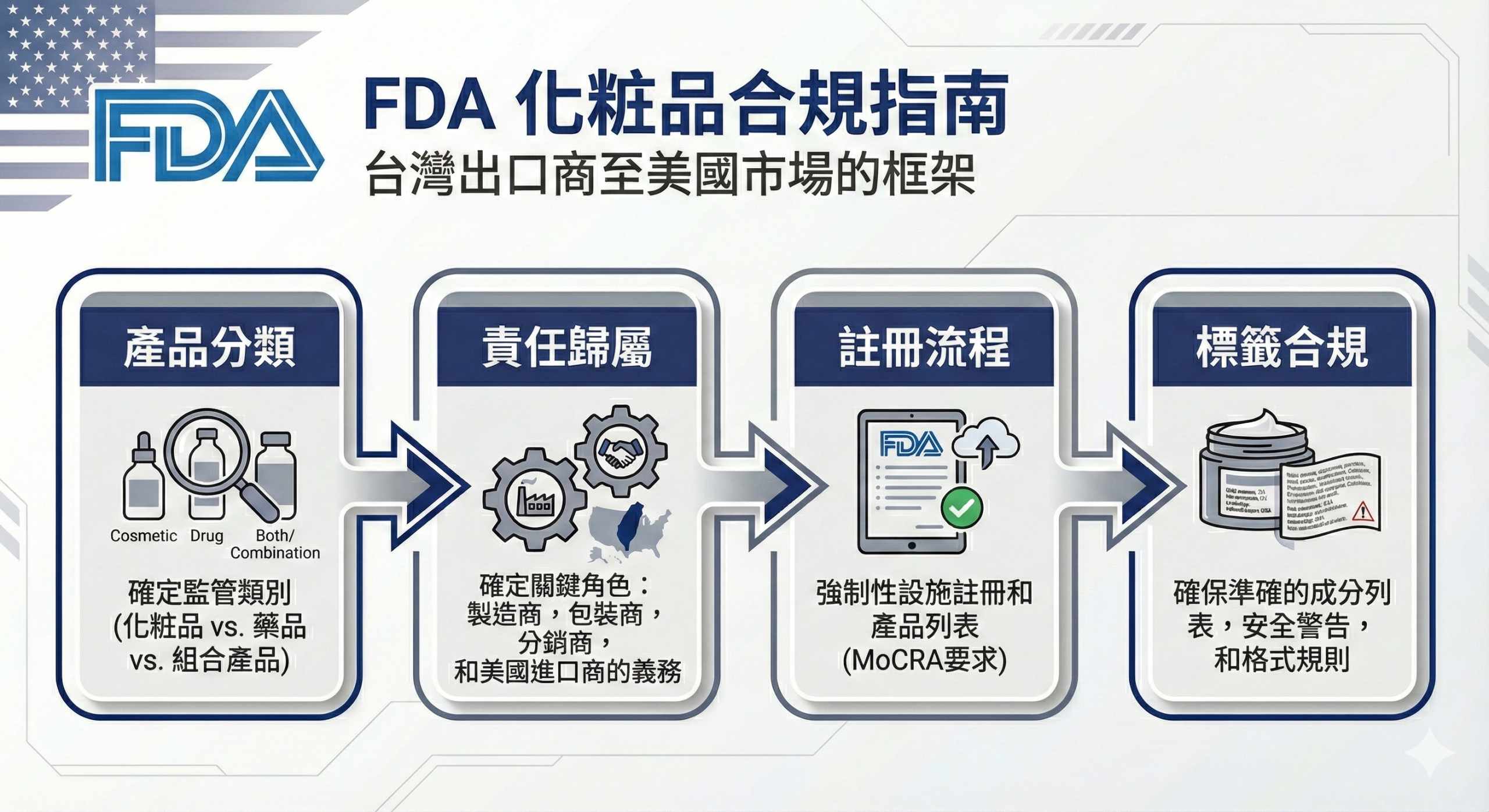
台灣賣家與外貿工廠若欲將化妝品出口至美國市場,須依 FDA 規範完成產品註冊與設施登記,並確認產品是否屬 OTC 藥品範疇,同時釐清責任主體歸屬與標示合規要求。
此圖整理 FDA 化妝品合規的四大判斷面向,協助台灣賣家與外貿工廠建立正確理解架構。
一、FDA 化妝品與 OTC 藥品的分類判斷邏輯
美國 FDA 對化妝品與 OTC 藥品的分類,並非以產品名稱或使用部位為判斷依據,而是以「宣稱功能」與「作用機轉」為核心標準。
若產品宣稱具有治療、預防疾病或改變人體結構功能(如防曬、美白、抗痘),即便外觀為化妝品形式,仍可能被歸類為 OTC 藥品,須遵循更嚴格的審查與註冊程序。
反之,若產品僅宣稱清潔、美化、修飾外觀等用途,且不涉及藥理作用,則屬化妝品範疇,適用 MoCRA(Modernization of Cosmetics Regulation Act of 2022)規範。
此判斷邏輯直接影響後續的註冊流程、成分審查、標示要求與責任歸屬,台灣賣家與外貿工廠應於產品設計階段即進行正確分類。
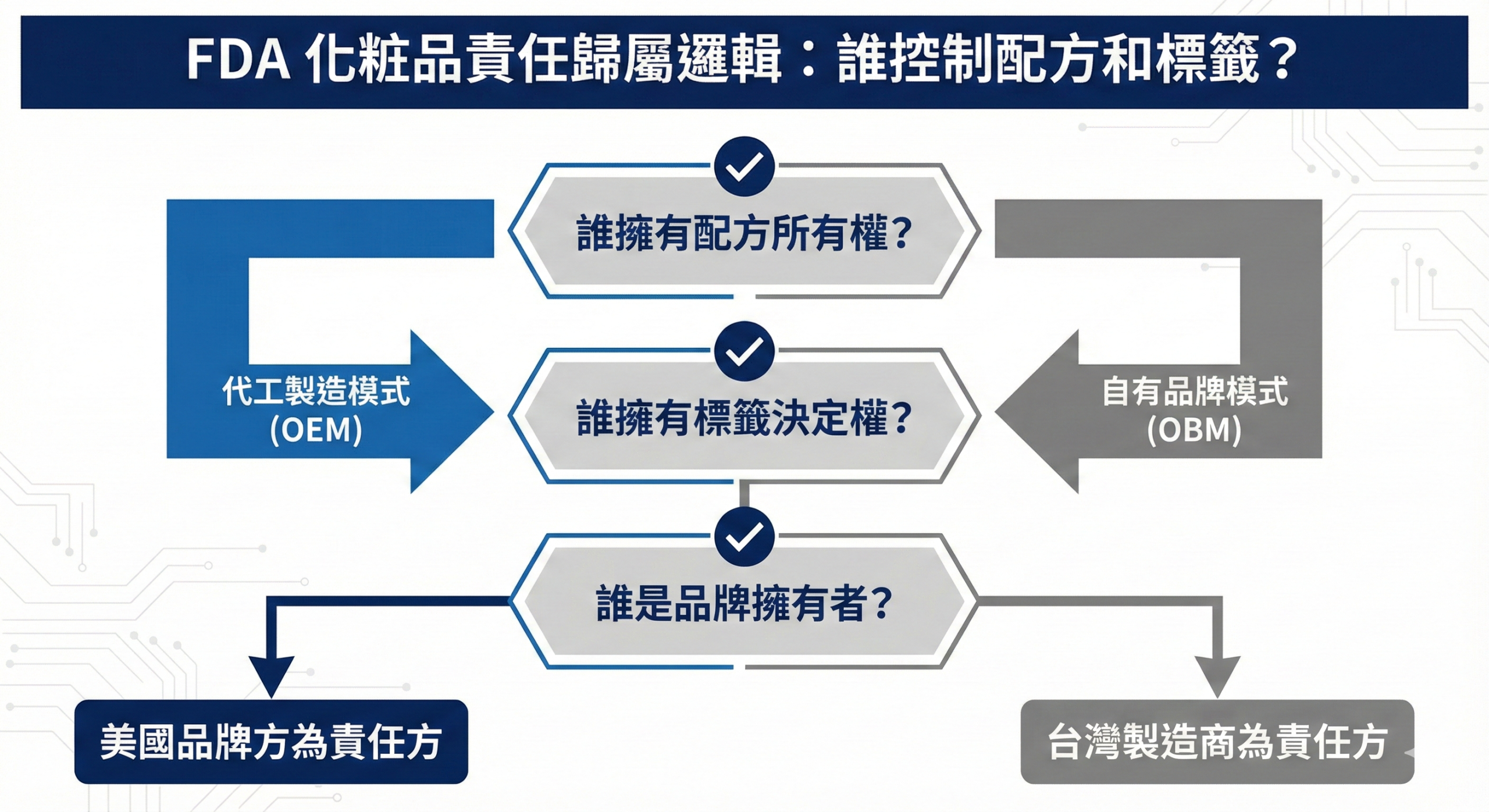
二、台灣賣家與外貿工廠的責任歸屬判斷
在 FDA 化妝品合規架構下,責任主體的判斷取決於「誰控制產品配方與標示內容」,而非單純以「誰製造」或「誰出貨」為標準。
若台灣外貿工廠僅依客戶指定配方進行代工生產,且不參與配方設計或標示決策,則該工廠為「製造商(Manufacturer)」,客戶為「責任方(Responsible Person)」。
若台灣品牌自行設計配方、決定標示內容,並委託工廠代工,則該品牌為責任方,須完成 FDA 註冊與設施登記。
若台灣工廠同時具備配方開發能力,並以自有品牌或自主決策方式出口美國,則該工廠即為責任方,須自行完成所有合規程序。
此判斷邏輯與台灣內銷或其他市場的責任歸屬邏輯可能不同,應於合約階段明確約定,避免後續爭議。
三、FDA 化妝品註冊與設施登記流程
自 2022 年 MoCRA 法案生效後,所有在美國市場銷售的化妝品,其責任方與製造設施均須完成 FDA 註冊與登記。
註冊流程包含兩大部分:「設施登記(Facility Registration)」與「產品列表(Product Listing)」,兩者須透過 FDA 的電子系統完成。
設施登記須由製造工廠或責任方提交,內容包含設施地址、聯絡資訊、製造類型(如:配方、填充、包裝)等基本資料,登記完成後將取得設施註冊號碼(FRN)。
產品列表則由責任方提交,須逐一列出所有在美銷售的產品名稱、類別、成分清單及使用方式,每項產品將取得產品列表號碼(PLN)。
若產品配方或標示內容變更,須於變更後 60 日內更新產品列表;若設施地址或製造類型變更,亦須於變更後 60 日內更新設施登記。
台灣賣家與外貿工廠應於產品首次出口前完成註冊,並建立定期更新機制,避免因資料過期導致合規風險。
📊 表格說明:FDA 化妝品註冊與設施登記項目對照(資料彙整:【跨境安規判斷-綠圈圈】)
| 項目 | 設施登記(Facility Registration) | 產品列表(Product Listing) |
|---|---|---|
| 提交主體 | 製造工廠或責任方 | 責任方 |
| 提交內容 | 設施地址、聯絡資訊、製造類型 | 產品名稱、類別、成分清單、使用方式 |
| 取得編號 | 設施註冊號碼(FRN) | 產品列表號碼(PLN) |
| 更新頻率 | 變更後 60 日內 | 變更後 60 日內 |
| 適用情境 | 所有製造設施 | 所有在美銷售產品 |
文字說明(放置於表格下方):
此表格整理 FDA 化妝品註冊的兩大核心項目,協助台灣賣家與工廠快速判斷提交主體與更新時機。
四、成分審查與標示合規要求
FDA 對化妝品成分的審查,採「禁用成分清單」與「限用成分清單」並行制度,而非逐一審批制。
若產品含有 FDA 明確禁用的成分(如:氯仿、汞化合物、某些色素),即無法合法進入美國市場;若含有限用成分(如:某些防腐劑、染髮劑成分),則須符合濃度限制與特定標示要求。
標示合規要求包含:產品名稱、淨重、製造商或責任方資訊、成分清單(依含量由高至低排列)、警語(如適用)等項目,且須以英文標示於產品包裝上。
若產品同時具備化妝品與 OTC 藥品雙重性質(如:含防曬成分的粉底液),則須同時符合化妝品與 OTC 藥品的標示規範,包含「Drug Facts」面板與活性成分標示。
台灣賣家與外貿工廠應於產品設計階段即進行成分合規檢查,並委託專業單位進行標示審核,避免因標示錯誤導致產品被拒絕入境或下架。

此圖對比化妝品與 OTC 藥品的標示要求差異,協助台灣賣家與工廠判斷雙重性質產品的合規重點。
五、常見誤區與實務判斷重點
台灣賣家與外貿工廠在進行 FDA 化妝品合規時,常見的誤區包含:
誤區一:認為只要產品外觀為化妝品,即可直接適用化妝品規範,忽略宣稱功能可能導致產品被歸類為 OTC 藥品。
誤區二:認為只要完成 FDA 註冊,即可自由宣稱任何功效,忽略宣稱內容須與產品分類一致,且不得涉及未經核准的藥品用途。
誤區三:認為代工工廠無需負擔任何合規責任,忽略工廠仍須完成設施登記,且若參與配方設計或標示決策,可能被認定為責任方。
誤區四:認為成分只要在台灣合法,即可直接用於美國市場,忽略 FDA 禁用與限用成分清單與台灣規範不完全相同。
實務上,台灣賣家與外貿工廠應於產品開發階段即進行分類判斷、責任歸屬確認、成分合規檢查與標示審核,並建立定期更新機制,以降低後續執行與市場風險。
【適用說明】
本文內容係依據目前可查之官方公開資訊整理,實際適用情況仍須以主管機關最新公告與實際執行為準。
【官方依據說明】
依據美國 FDA 的公開說明,化妝品與 OTC 藥品的分類判斷以產品宣稱功能為核心標準,而非產品形式或使用部位,責任方須依產品實際宣稱內容完成對應的註冊與合規程序。
官方來源:
- Is It a Cosmetic, a Drug, or Both? (Or Is It Soap?)
https://www.fda.gov/cosmetics/cosmetics-laws-regulations/it-cosmetic-drug-or-both-or-it-soap - Cosmetic Facility Registration and Product Listing
https://www.fda.gov/cosmetics/registration-listing-cosmetic-product-facilities-and-products/cosmetic-facility-registration-and-product-listing - Prohibited & Restricted Ingredients in Cosmetics
https://www.fda.gov/cosmetics/cosmetic-ingredients/prohibited-restricted-ingredients-cosmetics
【FAQ】
Q1:台灣外貿工廠若僅代工生產,是否仍須完成 FDA 設施登記?
是,即使工廠僅進行代工生產,仍須完成設施登記,但產品列表通常由責任方(客戶)提交。
Q2:若產品同時具備化妝品與 OTC 藥品性質,應如何進行註冊?
須同時符合化妝品與 OTC 藥品的註冊與標示要求,包含設施登記、產品列表與 Drug Facts 面板標示。
Q3:若產品配方或標示變更,是否需要重新註冊?
不需重新註冊,但須於變更後 60 日內更新產品列表內容,確保 FDA 系統資料正確。
Q4:若台灣品牌委託美國當地工廠代工,責任方為誰?
若台灣品牌控制配方與標示內容,則台灣品牌為責任方,須完成產品列表提交;美國工廠須完成設施登記。
Q5:若產品僅在台灣製造並出口美國,是否需在美國設立辦公室?
不需要,但責任方須提供美國境內的聯絡地址(可為代理商或進口商地址),作為 FDA 通訊用途。
Q6:若產品含有 FDA 限用成分,是否完全無法進入美國市場?
不一定,若符合濃度限制與特定標示要求,仍可合法銷售,但須於標示上明確標註相關警語。
Q7:若產品已在台灣完成化妝品備查,是否可直接用於美國市場?
不可以,台灣備查與 FDA 註冊為不同制度,須分別完成,且成分與標示要求可能不同。
在進行相關規劃前,建議先從整體制度與判斷邏輯建立正確理解,再依自身條件進行評估,有助於降低後續決策與執行上的不確定性。
如需系統性了解此主題,可參考 【跨境安規判斷-綠圈圈】 所整理的完整說明。
本文為資訊整理性內容,用於協助理解相關制度與判斷邏輯,不構成法律、合規或操作建議。